Katarzyna Pinkosz, Wprost: Panie Profesorze, brał Pan udział w pierwszym przeszczepie trzustki w Polsce, pierwszym przeszczepie wysp trzustkowych. A skąd idea – rewolucyjna – stworzenia bionicznej trzustki, wydrukowania organu, który – podobnie jak trzustka – będzie produkować insulinę?
Prof. Michał Wszoła: Jestem chirurgiem transplantologiem, wiele lat zajmowałem się przeszczepianiem trzustek, wysp trzustkowych: to metody leczenia pacjentów z ciężką, powikłaną cukrzycą, u których leczenie insuliną nie zapobiega rozwojowi powikłań, dlatego może rozwijać się u nich retinopatia, czyli uszkodzenie wzroku, dochodzi do ciężkich, gwałtownych zmian poziomu cukru czy też może również dojść do uszkodzenia nerek. Tacy pacjenci są kwalifikowani do transplantacji trzustki lub wysp trzustkowych.
Przeszczepienie trzustki to bardzo dobra metoda leczenia, jednak tylko w Polsce jest ok. 20 tys. osób z ciężkimi powikłaniami cukrzycy typu 1, którzy mogliby zostać zakwalifikowani do przeszczepienia trzustki lub wysp trzustkowych. Tymczasem w najlepszym dla transplantologii roku wykonaliśmy 41 przeszczepień trzustki. Musielibyśmy mieć 500 lat, by przeszczepić trzustkę u wszystkich, którzy już dziś potrzebują pomocy.
Poza tym: przeszczepienie trzustki jest obarczone dużym ryzykiem powikłań okołooperacyjnych. Trzustka nie ma własnego unaczynienia; jest zaopatrywana przez krew z okolicznych naczyń, dlatego przed przeszczepieniem trzeba zrobić bardzo skomplikowaną ich rekonstrukcję; konieczne jest też równocześnie przeszczepienie dwunastnicy. A pamiętajmy, że jest to ciężko chory pacjent, dlatego ryzyko powikłań jest wyższe.
Z kolei przeszczep wysepek trzustkowych jest znacznie mniej obciążający, ale nie ma tak dobrej skuteczności. To dlatego, że w trakcie izolacji wysp trzustkowych niszczymy układ naczyniowy oraz tzw. matriks zewnątrzkomórkowy, czyli taką kolagenową otoczkę wokół wysp trzustkowych. Można go porównać do zaprawy murarskiej. Gdy jest niszczony, w komórkach pojawia się sygnał do apoptozy: one obumierają. Nawet 80 proc. wysp trzustkowych obumiera w ciągu pierwszego miesiąca od przeszczepienia.
Czytaj też:
Okulista, który patrzy w przyszłość. Prof. Szaflik: „Najważniejsze są marzenia”
Tak więc idea drukowania trzustki wzięła się z tego, że dla tych pacjentów nie ma dziś dobrej drogi leczenia?
Tak: chcielibyśmy mieć coś tak mało inwazyjnego, jak przeszczepienie wysp trzustkowych, a tak skutecznego jak przeszczepienie trzustki. Analizując różne technologie, doszedłem do wniosku, że pomóc może biodrukowanie. Dzięki biodrukowi możemy całkowicie odwzorować matriks zewnątrzkomórkowy i wytworzyć układ naczyniowy. A jeśli będziemy mogli drukować narządy z wykorzystaniem komórek własnych pacjenta, to problemem przestanie być brak narządów do transplantacji.
Ile to lat – od pomysłu do dziś?
Pierwsza myśl nad rozwiązaniem problemu to były lata 2008-09. Ok. 2012 r. powstał pomysł bionicznej trzustki, czyli wydrukowania narządu.
Jak drukuje się trzustkę, organ, który musi produkować hormony?
Gdy zaczynaliśmy prace, mało kto na świecie myślał o biodrukowaniu, nie było biomateriałów do biodrukowania. Musieliśmy wszystko wytworzyć sami. Najpierw wyizolowaliśmy wyspy trzustkowe, umieściliśmy je w biodrukarce, żeby przekonać się, czy przeżyją sam proces biodrukowania. Od początku współpracowaliśmy w tym zakresie z zespołem prof. Święszkowskiego z Politechniki Warszawskiej, zespołem prof. Artura Kamińskiego z Warszawskiego Uniwersytetu Medycznego, z zespołem prof. Agnieszki Dobrzyń z Instytutu Nenckiego. Początkowymi pracami kierowała Fundacja Badań i Rozwoju Nauki, która jest jednostką naukową i organizacją OPP. Musieliśmy opracować technologię biodrukowania z wykorzystaniem wysp trzustkowych – np. z jaką będziemy to robić prędkością, jaka powinna być średnica dysz, jakie ciśnienia mogą być wykorzystane w trakcie biodruku.
Drugą rzeczą było opracowanie biotuszu, który będzie zastępował matriks zewnątrzkomórkowy. Chcieliśmy, żeby miał on dokładnie taki sam skład. Do wytworzenia go wykorzystaliśmy świńskie trzustki.
Obecnie dysponujemy biodrukarką z sześcioma dyszami, w których możemy mieszać biomateriał z żywymi komórkami.
W jednej mamy wyspy trzustkowe, razem z biomateriałem tworzącym matriks zewnątrzkomórkowy. W drugiej są zmieszane komórki śródbłonka i fibroblasty ze specjalnym biomateriałem, który buduje ściany układu naczyniowego. W trzeciej dyszy są zmieszane komórki śródbłonka ze specjalnym biotuszem, który buduje wnętrze układu naczyniowego.
Trzeba stworzyć nie tylko samą trzustkę, ale też połączyć ją z organizmem…
Musieliśmy odtworzyć system, który wzmacnia bioniczną trzustkę, by wytrzymywała wysokie ciśnienie, którym pompowana jest krew, by nie doszło w organizmie do przerwania ciągłości bionicznej trzustki. Następnie musieliśmy „wmontować” zewnętrzne naczynia, by połączyć trzustkę z ciałem. Nie byłoby to możliwe tylko dzięki biodrukowaniu, gdyż naczynia krwionośne są bardzo małe, mają grubość ok. 1-1,5 mm. Po wielu próbach zdecydowaliśmy się, że nie będziemy ich drukować, tylko użyjemy protez naczyniowych, wykorzystywanych w chirurgii naczyniowej. To się sprawdziło – jest to również nasz patent – musieliśmy opracować technologię łączenia bionicznej trzustki z organizmem.
Bioniczna trzustka jest już po próbach na zwierzętach. Przeszczepione im bioniczne trzustki podjęły pracę?
Tak. Obserwowaliśmy insulinoniezależność po przeszczepieniu, mamy dwumiesięczne okresy obserwacji. Dłuższych okresów obserwacji nie udało się osiągnąć również dlatego, że całe doświadczenie było zaplanowane na świniach, które w momencie przeszczepów ważyły ok. 30-40 kg. Jeśli przeszczepienie jest skuteczne, to zwierzęta normalnie się rozwijają; w ciągu 2 miesięcy podwajają masę ciała. Jednak trzustka nie rozwija się, nie rośnie razem z „pacjentem”. Po dwóch miesiącach bioniczna trzustka była już za mała w stosunku do masy zwierzęcia.
Czemu nie było testów na dorosłych zwierzętach?
To trudniejsze do przeprowadzenia, zarówno jeśli chodzi o prowadzenie takiego zwierzęcia, wykonanie zabiegu operacyjnego, ilość powikłań – świnie mają bardzo słaby układ sercowo-naczyniowy, ilość takich powikłań jak zawały serca, udary byłaby bardzo duża. Zaburzałoby to obserwację. Oczywiście, jest możliwe przeprowadzanie badań na mniejszych zwierzętach, np. na mini-pigach, jednak w Polsce dostęp do takich zwierząt jest ograniczony. Dużym problemem są też koszty. Nie wykluczamy, że jednak dalsze doświadczenia, mające na celu zdobywanie dalszej wiedzy, zrobimy wykorzystując któryś ze wspomnianych wcześniej modeli.
Wszyscy czekamy na pierwszy przeszczep bionicznej trzustki u człowieka. Kiedy jest możliwe rozpoczęcie badań klinicznych u ludzi?
Z punktu widzenia bezpieczeństwa takie przeszczepienia byłyby już możliwe. Zanim jednak rozpoczniemy badania kliniczne u ludzi, musimy przeprowadzić pewne inwestycje infrastrukturalne, rozbudować clean-roomy, laboratoria czyste, w których będzie można drukować bioniczne trzustki. Na potrzeby doświadczeń laboratoryjnych możemy już dziś to robić, jednak na potrzeby badań u ludzi nie jest to wystarczające. Bioniczna trzustka została zakwalifikowana przez Europejską Agencję Leków (EMA) jako Produkt Leczniczy Terapii Zaawansowanej (advanced therapy medicinal product – ATMP), co jasno określa, w jaki sposób powinna być wytwarzana. Nakłada to bardzo duże obowiązki z puntu widzenia produkcyjnego, by było to bezpieczne dla pacjenta. Konieczne są inwestycje.
Czytaj też:
Z osiągnięć polskich kardiologów możemy być dumni. „Inwestujmy w badania i młodych naukowców”
Kiedy jednak ten pierwszy przeszczep mógłby się odbyć?
Myślę, że od momentu, gdy będziemy mieć zapewnione środki finansowe i będziemy mogli ruszyć pełną parą z inwestycjami, potrzebujemy ok. 2 lat na przygotowanie infrastruktury, uzyskanie zgód, kwalifikacje pacjentów.
Nie pierwszy raz pojawia się w naszej rozmowie wątek finansowy. Skąd pieniądze na badania nad bioniczną trzustką?
Obecnie wszelkie prace są finansowane przez prywatnych inwestorów. Cały projekt rozpoczął się jednak dzięki grantowi STRATEGMED, który pozyskaliśmy w 2016 roku z NCBiR. Program zakończył się sukcesem, założyliśmy spółkę Polbionica, która dalej pracuje nad sukcesem bionicznej trzustki, współpracując z Fundacją Badań i Rozwoju Nauki i naszymi pierwszymi konsorcjantami naukowymi. Dodatkowo dołączył do nas zespół prof. Jakuba Rybki z Centrum Zaawansowanych Technologii Uniwersytetu Adama Mickiewicza w Poznaniu oraz centrum medyczne MediSpace. Staramy się pozyskać pieniądze publiczne na ten projekt z grantów, prowadzimy też rozmowy z inwestorami. Potrzebne są duże inwestycje infrastrukturalne, nie możemy ich rozpocząć, dopóki nie mamy pełnej sumy pieniędzy.
Gdyby udało się zacząć wykonywać przeszczepy bionicznej trzustki, byłby to ogromny sukces – Pana, zespołów badawczych, ale też całej polskiej nauki i medycyny. Czy na świecie są prowadzone podobne projekty? Jest ryzyko, że Polskę ktoś wyprzedzi?
Jest wiele ośrodków zajmujących się podobnymi badaniami. W Europie są prowadzone dwa projekty finansowane przez Komisję Europejską, które zajmują się biodrukiem w aspekcie tkanki trzustkowej, ale one nie mają na celu aplikacji klinicznej. Jeden z nich rozwija bardzo ciekawą nową technologię biodruku; celem ma być wytworzenie tkanki trzustkowej na potrzebę badań przedklinicznych leków. Drugi ma na celu wykorzystanie biodruku i wytworzenie tkanki trzustkowej zarodkowej, która będzie rozwijała się w laboratoriach i będzie mogła służyć badaniom podstawowym. W USA są zespoły, które również planują i rozwijają biodruk. Nikt nie podaje, żeby był na takim etapie zaawansowania, na jakim my jesteśmy. Trzeba pamiętać, że nie zawsze zespoły chwalą się wszystkimi swoimi osiągnięciami.
Najważniejsze jednak nie jest to, kto to zrobi pierwszy, tylko kto to zrobi dobrze. Rozwiązanie musi być bezpieczne dla pacjenta oraz skuteczne.
Mamy szansę na stworzenie bardzo dobrego polskiego rozwiązania, a bardzo czekamy na polskie innowacje, leki…
Bardzo zależałoby nam, żeby móc kontynuować ten projekt. Faktem jest jednak, że system wspierania innowacyjnej nauki jest w Polsce skomplikowany. Sam jestem ewaluatorem badań w Komisji Europejskiej; mam porównanie, jak traktowani są beneficjenci programów naukowych w Komisji Europejskiej i w Polsce. W Komisji Europejskiej, w przypadku projektów, które otrzymały dofinansowanie, próbuje się robić wszystko, by zostały one zakończone z sukcesem. Podczas wykonywania prac zawsze pojawia się wiele zmiennych, których nie brano wcześniej pod uwagę, bo nie było to możliwe. Jednak w Komisji Europejskiej jest zasada, by starać się pomagać rozwiązywać problemy. W Polsce patrzy się często na to, czy projekt jest realizowany według wcześniejszych założeń i każda próba zmiany spotyka się z niezrozumieniem i czasem znacznym przeciąganiem decyzji, co oczywiście utrudnia płynną pracę naukową.
Wracając do bionicznej trzustki – to byłaby trzustka bardzo spersonalizowana, tworzona z komórek własnych pacjenta?
Nie zawsze. Są dwie grupy pacjentów, dla których pomocą mogłaby być bioniczna trzustka: osoby z ciężką powikłaną cukrzycą typu 1 oraz pacjenci z przewlekłym zapaleniem trzustki, dla których nie ma innej formy leczenia. U pacjentów z przewlekłym zapaleniem trzustki możemy w 100 procentach korzystać z ich własnych komórek wysp trzustkowych, fibroblastów, komórek śródbłonka. W przypadku pacjentów z cukrzycą typu 1 – komórki śródbłonka i fibroblasty będą pochodziły od pacjentów, natomiast wyspy trzustkowe – nie, dlatego że cechą charakterystyczną cukrzycy typu 1 jest niszczenie własnych wysp trzustkowych pacjenta.
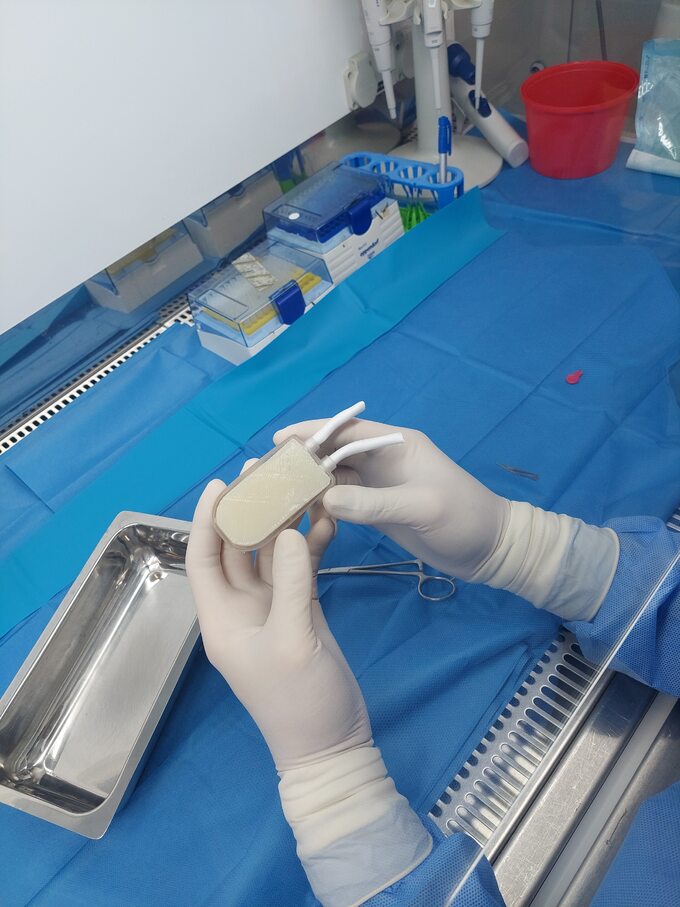
Bioniczną trzustką nie rozwiążemy wszystkich problemów, robimy jednak ważny krok. Potem możemy myśleć o transformacji komórek macierzystych w kierunku komórek produkujących insulinę i glukagon oraz stworzenia sztucznych wysepek trzustkowych, które będą funkcjonowały tak jak prawdziwe. Jednak na dziś, w naszych rękach, nie jest to jeszcze możliwe.
Zdecydowaliśmy, że nie będziemy czekali kolejnych 3-5 lat, aż ta technologia będzie gotowa do zastosowania, tylko skorzystamy z wysp trzustkowych pobranych od dawcy. W ciągu roku bylibyśmy w stanie doprowadzić do 300-400 tego typu przeszczepów w Polsce i nawet 10 tysięcy na świecie. To 10 razy więcej niż wykonanych przeszczepów trzustki w najlepszym roku. A pamiętajmy, że mówimy o pacjentach, którzy mogą stracić wzrok lub umrzeć z powodu ciężkich powikłań.
To opcja na razie tylko dla dorosłych pacjentów?
Nie planowaliśmy na dziś badania klinicznego na dzieciach. Wszystko zależy, jakie będą wyniki pierwszych przeszczepów – jeśli będą pozytywne, to nie wykluczamy, że w przyszłości będziemy chcieli prowadzić kolejne badania kliniczne także u młodych pacjentów, którzy mają bardzo ciężki przebieg cukrzycy. Zawsze musimy mieć pewność, że korzyści z zabiegu będą znacznie przewyższać ryzyko.
Przyszłością byłoby jednak przeszczepienie komórek macierzystych?
To byłby kolejny etap. Komórki macierzyste są nadzieją medycyny, jednak niewiele jeszcze o nich wiemy. Jedno z badań klinicznych prowadzonych na świecie zostało przerwane po tym, jak dwóch pacjentów zmarło po przeszczepieniu transformowanych komórek macierzystych, które miały produkować insulinę. Jest prowadzona analiza, co się stało, czy zgony były powiązane z przeszczepieniem. Ostatnio pokazała się publikacja w Nature mówiąca o zwiększonym ryzyku chorób nowotworowych po transplantacji komórek macierzystych. Do wszystkiego trzeba podchodzić ostrożnie – wprawdzie nasza formuła bionicznej trzustki daje poczucie bezpieczeństwa dla pacjenta także w kontekście transformowanych komórek macierzystych – zawsze łatwo możemy ją usunąć w przypadku problemów – to jest zupełnie inaczej niż w sytuacji przeszczepiania transformowanych komórek do wątroby.
Reasumując, trzeba być ostrożnym i pamiętać, że nawet jeśli mamy coś bardzo dobrze przebadane na zwierzętach, to nie musi to być cudownym rozwiązaniem dla pacjentów.
Jest Pan bardzo ostrożny w mówieniu o sukcesach…
Jestem śmiały w tworzeniu wizji rozwiązań i innowacji, gdy jednak podchodzimy do kwalifikacji pacjenta, to trzeba być naprawdę bardzo ostrożnym, by pomóc, a nie zaszkodzić.
Biodrukowanie narządów to przyszłość medycyny?
Biodruk w wielu aspektach będzie pomocny. Nie będzie jednak tak, że wydrukujemy całego człowieka, ustawimy drukarkę, która wydrukuje wątrobę, trzustkę, serce i poda pacjentowi. Biodruk ma wiele ograniczeń: my zresztą także wykorzystujemy inne technologie.
Poza tym rozwija się wiele innych technologii, które mogą okazać się w pewnych aspektach skuteczniejsze i łatwiejsze do wdrożenia. Już wiele lat temu, patrząc na transplantologię, doszedłem do wniosku, że ten święty Graal – nieograniczony dostęp do narządów do transplantacji dla każdego organu (serca, płuc, wątroby, nerek, trzustki) – będzie nieco inny.
Jest np. pomysł wykorzystania zwierząt z modyfikowanym układem genetycznym. U dwóch pacjentów w USA już przeszczepiono serce od zmodyfikowanej genetycznie świni. Z kolei w Nowym Jorku w kilku przypadkach przeszczepiono tego typu nerkę osobom, u których stwierdzono śmierć mózgu, a ich rodziny zgodziły się na przeprowadzenie tego zabiegu – by przekonać się, czy dojdzie do produkcji moczu. Obecnie trwają przygotowania do przeszczepienia nerki od zmodyfikowanej genetycznie świni pacjentowi. W przypadku trzustki tego typu rozwiązania nie mają jednak zastosowania, gdyż jest ona na tyle skomplikowanym narządem i różnym międzygatunkowo, że nie jest to możliwe. Biodrukowana trzustka wydaje się być pewniejszym rozwiązaniem. Biodruk na pewno sprawdzi się jednak w przypadku leczenia skóry, owrzodzeń skórnych, problemów ortopedycznych, czy konieczności wymiany rogówki.
Mimo to jednak, że nie wiemy, która droga prowadzi do celu, to ważna jest kontynuacja projektów naukowych, gdyż to przede wszystkim inwestycja w rozwój nauki i polski wkład w światową naukę i medycynę?
Zdobywamy doświadczenia. Przez te 10 lat wytworzyliśmy innowacyjne materiały, zyskaliśmy wiedzę, w jaki sposób drukować bioniczną trzustkę, wytworzyliśmy bioreaktor, czyli urządzenie, w którym przechowujemy wydrukowaną bioniczną trzustkę i oceniamy, czy nadaje się do przeszczepienia. Stworzyliśmy cały ekosystem, który może być wykorzystywany i implementowany również do innych rozwiązań.
Prof. dr hab. n. med. Michał Wszoła, chirurg ogólny, transplantolog, proktolog i gastrolog, pomysłodawca i współautor bionicznej trzustki, przewodniczący Rady Konsorcjum Bionic oraz przewodniczący Rady Naukowej Fundacji Badań i Rozwoju Nauki, Prezes spółki Polbionica.
Polska nauka
dla rozwoju medycyny i zdrowia Polaków
Przeczytaj inne artykuły poświęcone polskiej nauce
Projekt współfinansowany ze środków Ministerstwa Edukacji i Nauki w ramach programu „Społeczna Odpowiedzialność Nauki”

